Erfahren Sie hier, was in diesem Zusammenhang unter Fachpersonen zu verstehen ist und was diese bei der Beschaffung ausländischer Medizinprodukte zu beachten haben.
Erfahren Sie hier, was in diesem Zusammenhang unter Fachpersonen zu verstehen ist und was diese bei der Beschaffung ausländischer Medizinprodukte zu beachten haben.
Bestimmungen der MepV
Die Schweizer Medizinprodukteverordnung (MepV) dient der Angleichung des Schweizer Rechts an die europäische Medizinprodukte-Verordnung (MDR) und ermöglicht es Fachpersonen, ausländische CE-gekennzeichnete Medizinprodukte direkt im Ausland zu beschaffen und national anzuwenden. Dies bedeutet, dass keine nationalen Prüf-, Registrierungs- und Dokumentationspflichten bei der Beschaffung im Ausland gelten.
In der Schweiz herrschen erhebliche Versorgungsdefizite bei Medizinprodukten, die laut einer Studie durch das bestehende Regulierungssystem verursacht werden. Eine regulatorische Herausforderung ist beispielsweise die neue europäische Medizinprodukte-Verordnung (MDR), die eine Vielzahl von Vorschriften für die Zulassung und den Verkauf von medizinischen Produkten einführt. Die hohe Abhängigkeit der Schweiz von ausländischen Lieferanten für medizinische Produkte ist ein weiterer Grund für die Versorgungsdefizite.
Inverkehrbringung Medizinprodukte
Die Schweizer Medizinprodukteverordnung (MPV) ermöglicht es Fachpersonen, Medizinprodukte im Ausland zu beschaffen und national anzuwenden, ohne dass eine Inverkehrbringung in der Schweiz erforderlich ist.
Doch was genau ist unter dieser Beschaffungsart durch Fachpersonen zu verstehen?
Fachpersonen können ausländische CE-gekennzeichnete Medizinprodukte direkt im Ausland beschaffen und national anwenden, ohne dass daraus eine Inverkehrbringung in der Schweiz resultiert. Die Beschaffungstätigkeiten können von den Fachpersonen selbst ausgeführt werden, oder an Dritte delegiert werden. Dabei tragen sie jedoch eine große Verantwortung, da sie dafür sorgen müssen, dass die beschafften Produkte den Anforderungen der MDR entsprechen.
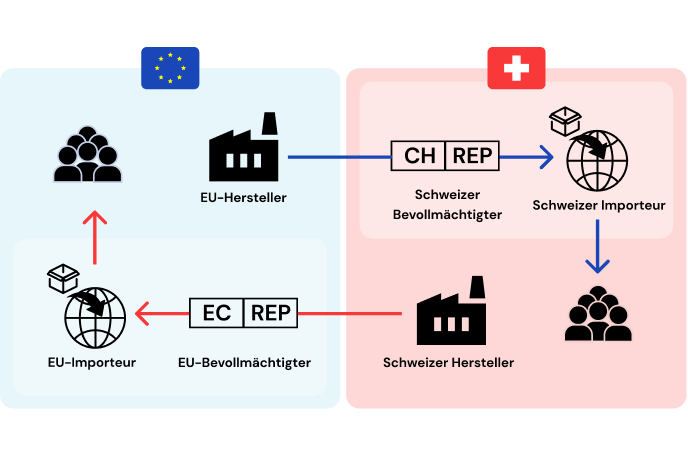
Fachpersonen können Medizinprodukte im Ausland beschaffen und national anzuwenden, ohne dass eine Inverkehrbringung in der Schweiz erforderlich ist.
Lieferkontinuität
Die Verantwortung der Fachpersonen bezieht sich auch auf die Dokumentation der Beschaffungsprozesse sowie auf die Überwachung und Nachverfolgung der Produkte, um eine Lieferkontinuität sicherzustellen. Um mögliche Auswirkungen auf die Lieferkontinuität zu minimieren, sollten Fachpersonen bei der Beschaffung von Medizinprodukten im Ausland sorgfältig prüfen, ob die Produkte den Anforderungen der MDR entsprechen und ob die Lieferanten verlässlich und zertifiziert sind.
Rechtliche Vorgaben
Insgesamt ist die Beschaffung von CE-gekennzeichneten Medizinprodukten im Ausland eine Möglichkeit für Fachpersonen, ihre Bedürfnisse zu decken und Lieferengpässe zu vermeiden. Es ist jedoch wichtig, dass Fachpersonen die rechtlichen Vorgaben beachten und ihre Verantwortung wahrnehmen, um die Sicherheit und Wirksamkeit der beschafften Produkte zu gewährleisten. Bei Missachtung der rechtlichen Vorgaben können Konsequenzen wie Haftungsklagen oder Einschränkungen bei der Zulassung von Produkten eintreten.
Unterstützung Direktbeschaffung
Sie benötigen Unterstützung beim Direktimport von CE-gekennzeichneten Produkten oder sind auf der Suche nach einem kompetenten Partner für die Distribution Ihrer Marke in der Schweiz? Durch die Distribution und der Vermarktung unserer Eigenmarken können wir auf eine langjährige Erfahrung im Vertrieb und Marketing zurückblicken. Diese Erfahrungswerte geben wir gerne an Sie weiter.
Wenden Sie sich bei Fragen gerne telefonisch oder per Mail an uns oder füllen Sie ganz einfach unser Kontaktformular aus.